从ICH 最新发布的 M4Q(R2) 草案可以看出,此次修订对药学注册申报的整体架构带来了较大幅度的调整。尽管 M4Q(R2) 仍然沿用了 Module 2(质量总体概述) 和 Module 3(质量) 的结构体系,但与 M4Q(R1) 相比,R2 在 M2 部分的改动尤为显著。在 R1 框架下,药学申报的主体内容基本集中在 Module 3(M3),而 Module 2(涉及药学内容的QOS)仅被视作对 M3 内容的精简总结,且在某些早期临床注册阶段,部分监管机构甚至对 M2 QOS的内容不做强制要求。然而在 R2 中,M2 的内容被重新设计与细化,成为体现药学开发策略和整体质量控制理念的重要模块。M4Q(R2) 将 M2 拆分为六个子章节:
2.3.1 General Information
2.3.2 Overall Development and Control Strategy
2.3.3 Core Quality Information
2.3.4 Development Summaries and Justifications
2.3.5 Lifecycle Management Information
2.3.6 Product Quality Benefit-Risk Considerations
其中 2.3.3 和 2.3.4 被视为整个 CMC信息的核心章节,用于系统展示产品的关键质量属性(CQA)、控制策略、开发依据与科学合理性。这种结构安排有助于从全生命周期的视角呈现药品质量管理的全貌。
我们熟知,R1 的 M3 主要围绕 Drug Substance(原料药,DS) 和 Drug Product(制剂,DP) 两个核心模块展开,相关物料、试剂、中间体的控制信息也归入这两个部分中。对于传统的小分子化学药而言,这种架构简洁明了、逻辑清晰,能够很好地支撑其注册申报工作。但随着药品类型的日益多样化,如细胞与基因治疗产品、个体化治疗产品、药械组合产品等,传统的 DS/DP 划分逐渐显得力不从心。这类产品在开发过程中可能涉及高风险原材料、复杂生产工艺,或在质量控制上存在跨模块的信息交叉,若仍强行套入 DS/DP 模式,往往难以准确表达其产品特性与控制策略。例如某些关键原材料可能不属于传统意义上的“原料药”,若将其放入 DS 模块则机制上不合理,放入普通物料章节又可能导致文件结构冗长、逻辑混乱。为了适应这些新型产品的注册需求,M4Q(R2) 扩展了其适用范围,并在 M2 与 M3 中设立了更多元化的结构:无论是起始物料、中间体、辅料,还是与药品组合使用的器械组件,均可在相应的章节中体现其生产与质量控制信息,避免“信息被迫归类”的尴尬。同时,指南也明确指出,申报方应根据产品特点、申报阶段以及监管机构的具体要求,合理选择适用章节,对不适用的内容予以简化或略去。
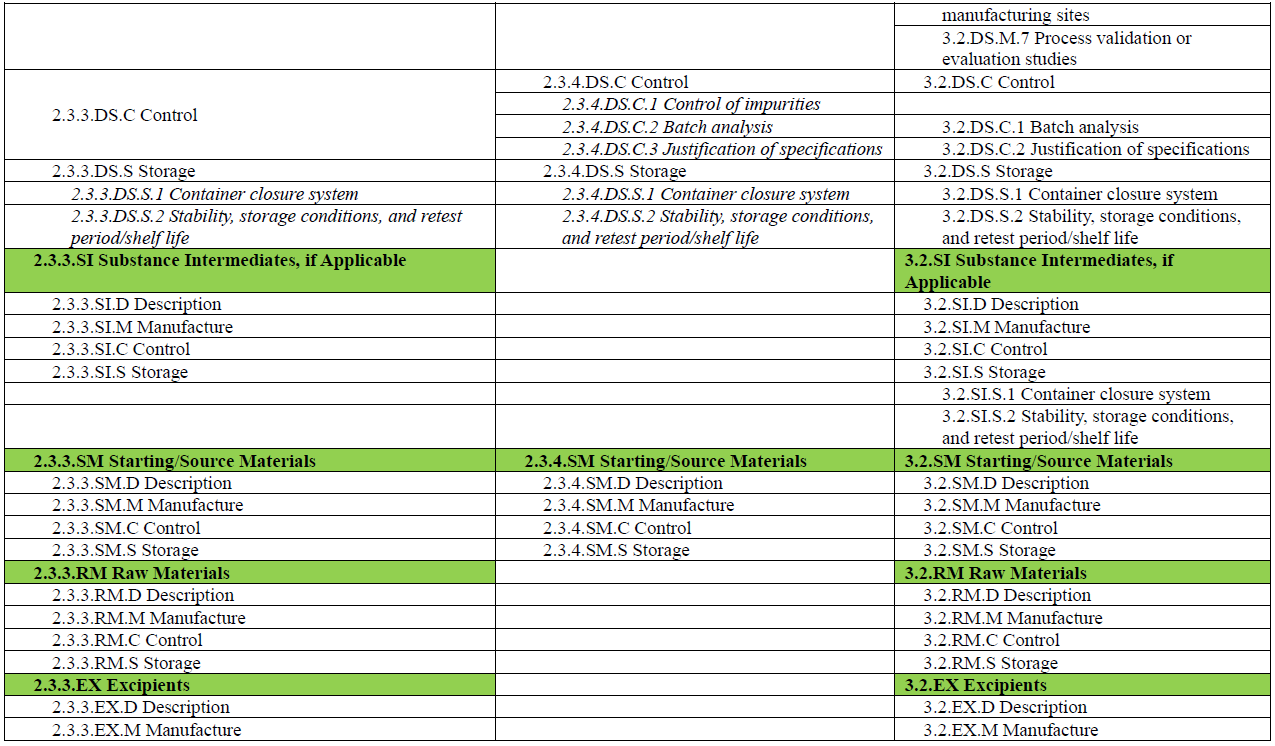
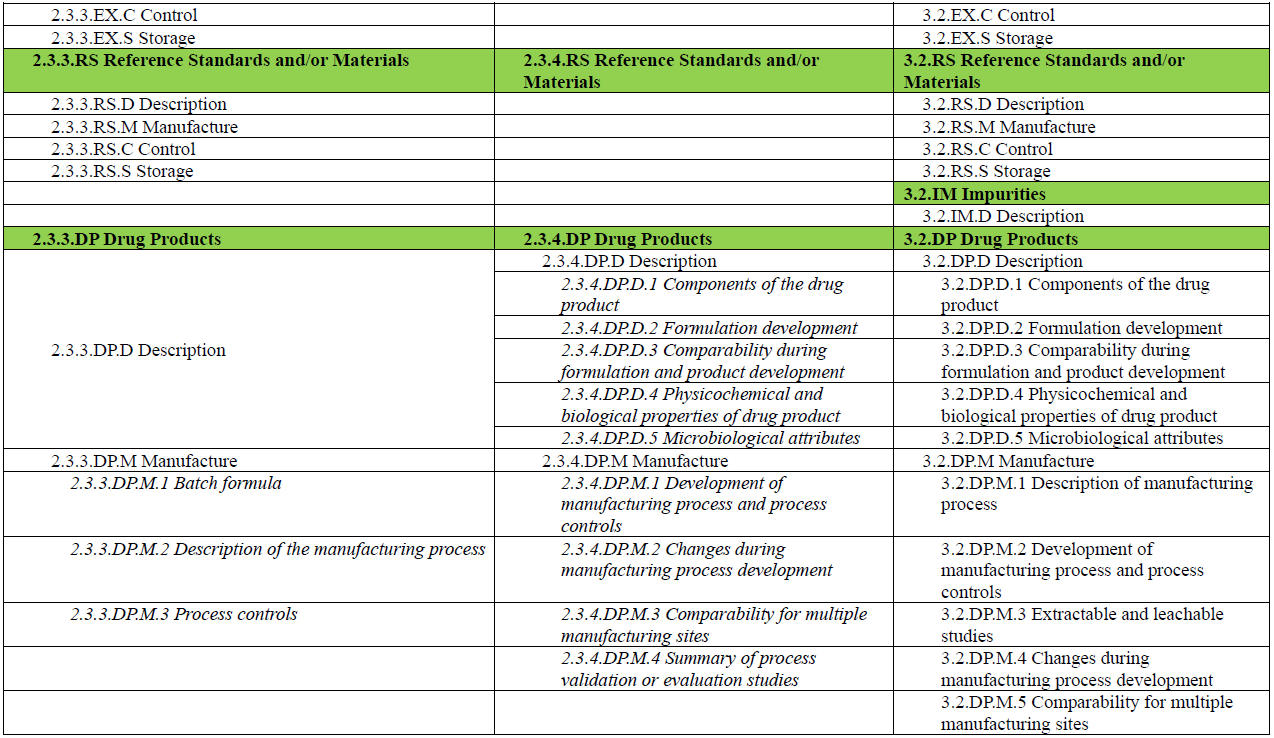
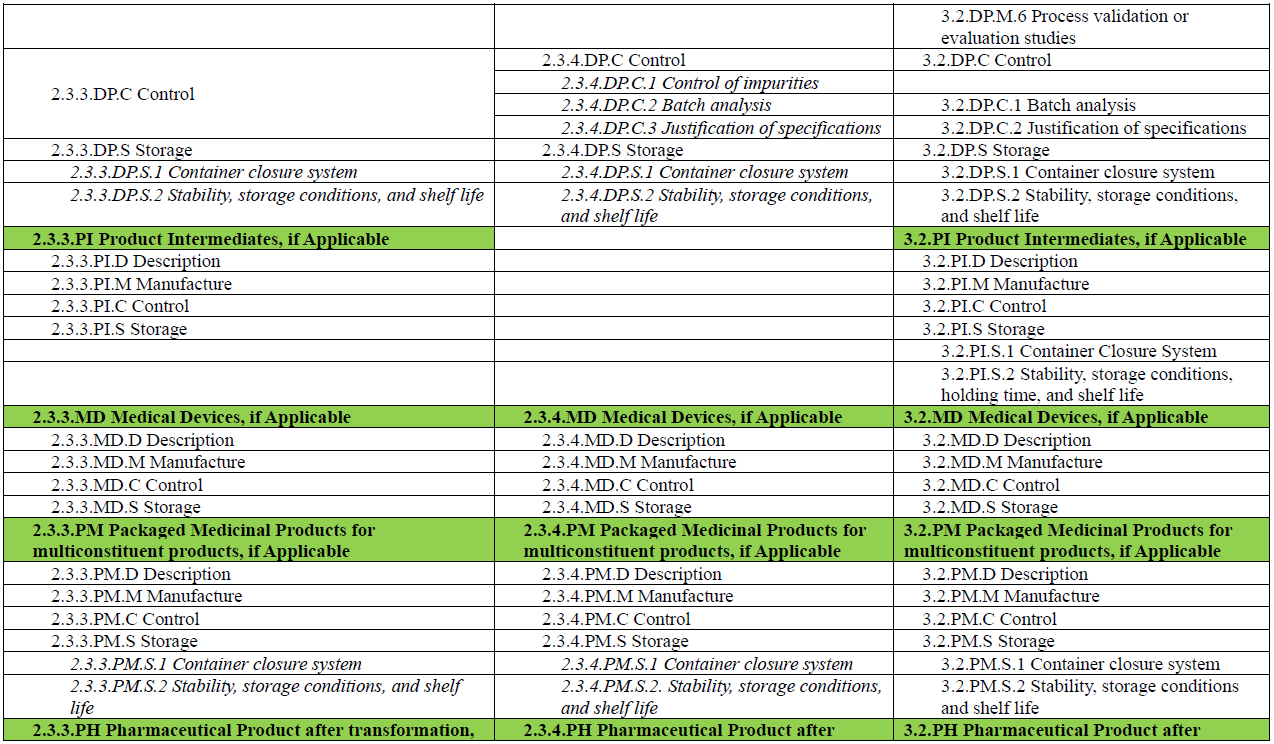
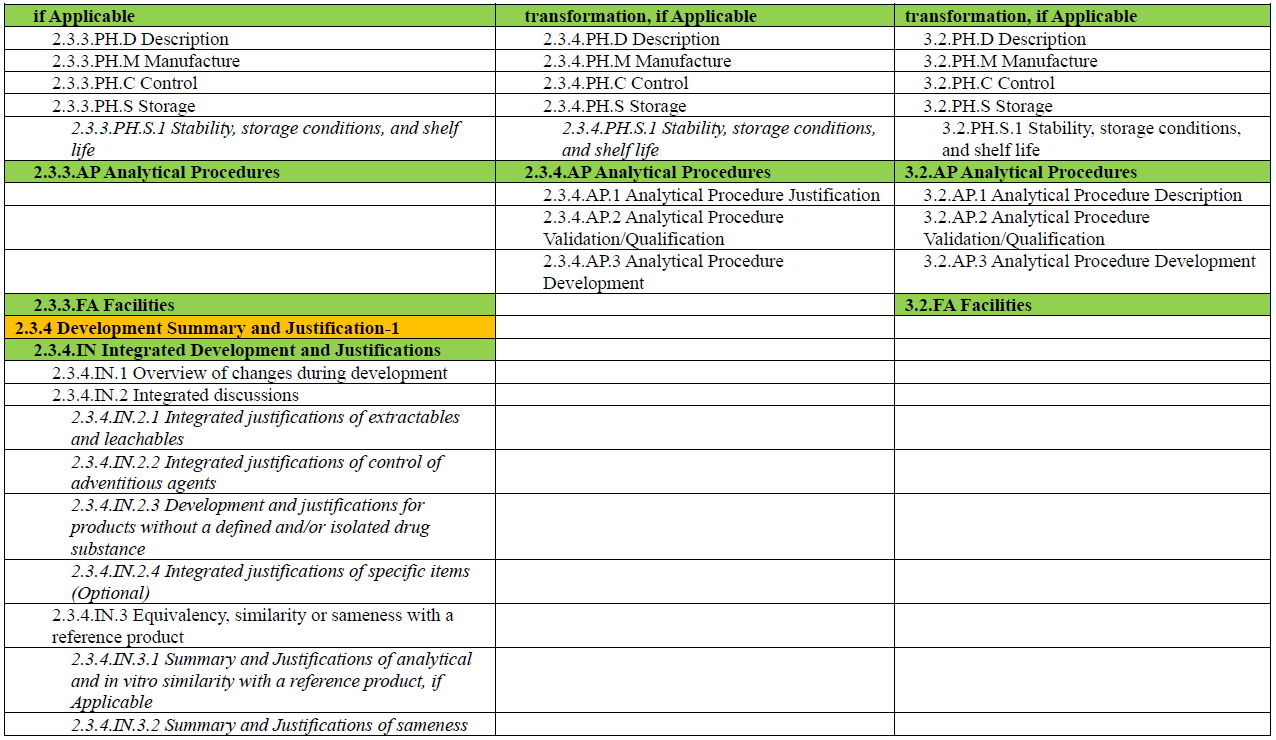
此外,M3 在 R2 中的角色也有所转变。如果说在 R1 中,M3 是药学注册的主体模块,那么在 R2 中,M3 更像是对 M2 内容的补充与支撑:用于承载支持 M2.3 核心信息所需的详细方法、实验数据与背景材料,如分析方法的验证资料、工艺参数数据、稳定性研究报告等。M4Q(R2) 草案中也展示了 M2.3.3、M2.3.4 与 M3.2 各章节之间的内容对应关系(见下图),以便读者更好地理解模块之间的衔接与层级逻辑。
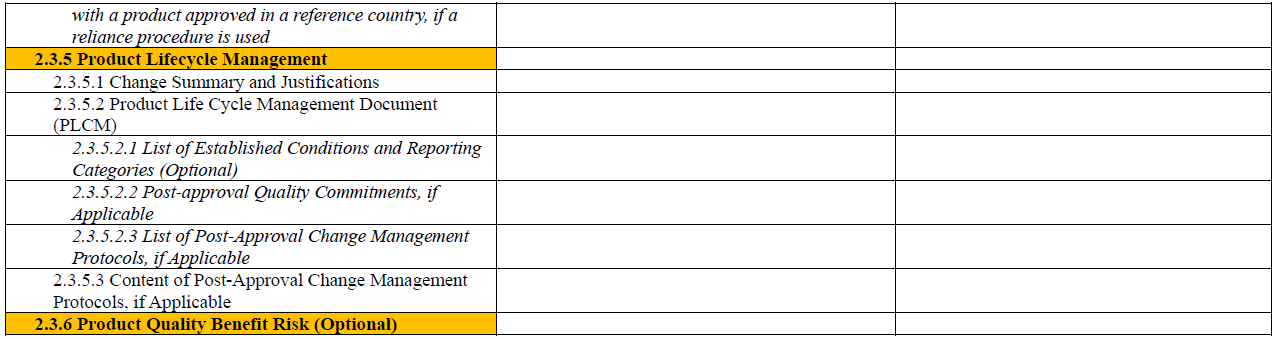
另外,为了便于读者对 M4Q(R2) 中 Module 2 与 Module 3 的整体结构与内容安排有更加直观的理解,本文将草案中列出的各章节内容整理成表格形式(见文末)。表格中将功能类似、内容相关的章节进行对应展示,便于横向对比与理解。每个章节所应包含的信息,ICH 指南草案中均有详细说明与示例,建议读者结合原文查阅(https://www.ich.org/page/ctd),以便更好地把握撰写要点。
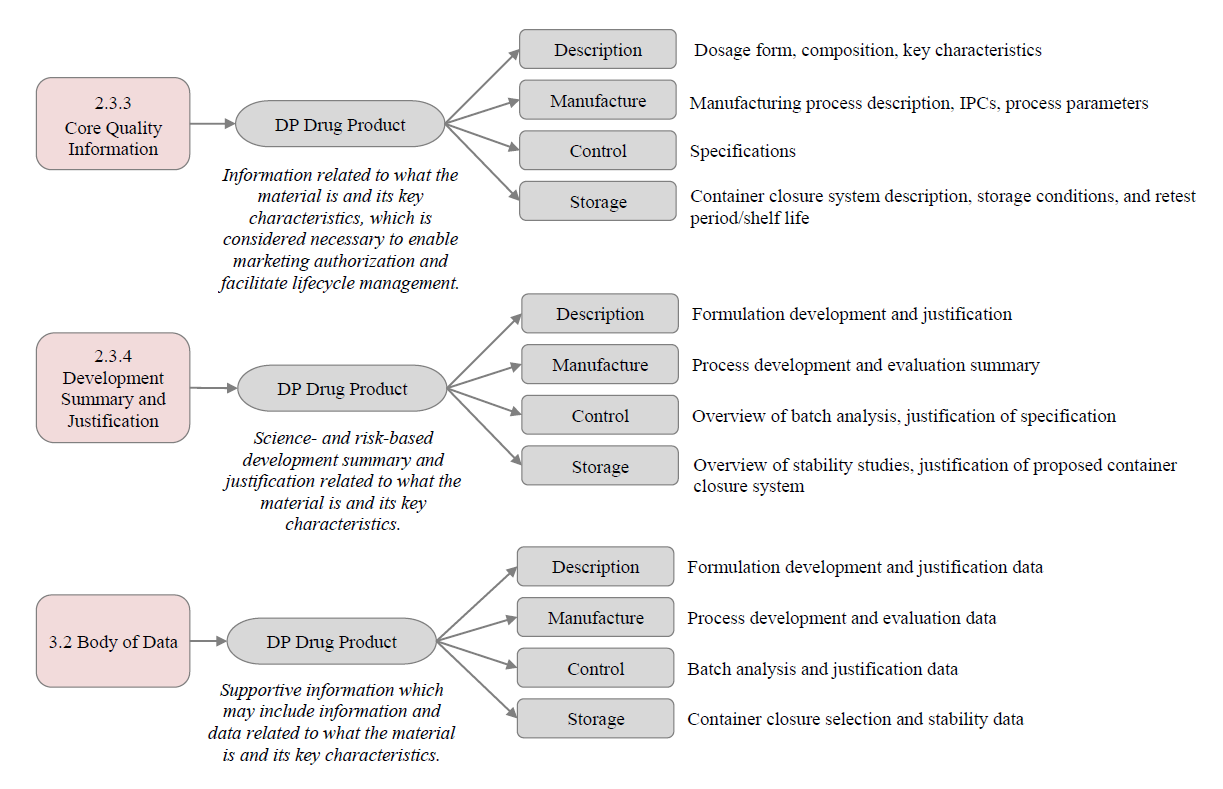
虽然 M4Q(R2) 在药学注册资料的结构和表达方式上带来了较大调整,但其核心仍然围绕“以产品为中心的药学开发与质量控制逻辑”展开,强调以风险为基础的控制策略、科学合理的开发依据以及全生命周期的管理理念。需要指出的是,目前 M4Q(R2) 仍处于征求意见草案阶段,尚未正式发布或强制执行,未来各国/地区的监管机构是否采纳以及何时采纳尚不确定。但即便如此,该框架已经对药学资料的呈现方式提供了更清晰的方向,对于注册申报人来说,提前理解其逻辑、结构与技术要求,也将有助于提高资料撰写质量,更好地应对未来国际化注册的挑战。

撰稿人:Arlie Ling
