1)完全暂停(Complete clinical hold),IND申请人需要延迟或暂停该IND申请下的所有临床工作;
2)部分暂停(Partial clinical hold),IND申请人需要延迟或暂停该IND申请下的部分临床工作,例如FDA仅允许IND下某项临床研究的进行,或仅允许某试验方案的一部分研究进行。
FDA对IND申请人发出的临床试验暂停令的时间一般发生在递交首次IND申请后的30个日历日内,但也可能发生在临床开发期间。本文将就导致临床试验暂停的原因、解除和规避建议展开介绍。
1、导致临床试验暂停的原因
根据FDA法规21CFR312.42,FDA发出临床试验暂停令的情形与原因通常包括以下几种:针对IND下的临床1期研究:
(1) 人类受试者正在或将面临不合理且重大的疾病或伤害风险;
(2) IND中指定的临床研究者资质不符合要求,例如缺乏科学培训、经验不足等;
(3) 研究者手册存在误导性、错误或不完整;
(4) IND中提交的信息不充分(未按21CFR 312.23要求准备),不足以让FDA评估拟定的临床研究给试验受试者带来的风险;
(5) 研究药物可能具有生殖毒性(即影响生殖器官)或发育毒性(即影响潜在后代),但未能充分评估和管理潜在风险,但下列情况不适用:A. 拟议的研究仅涉及某一种性别,B. 拟议的研究在未患有研究药物针对的疾病或状况的受试者中进行,C. 该研究产品有另一项未排除具有生殖潜力的其他性别成员的试验已完成、正在进行或将在FDA同意的合理时间内开展。
针对IND下的临床2期或3期研究:
(1) 任何上述1期研究涉及的情形;
(2) 试验计划或临床方案存在明显设计缺陷,无法实现其既定目标。
针对扩展使用(Expanded Access,指一种药物在被批准之前或者在被批准之外使用):
(1) 不满足21CFR312.305中允许进行扩大使用的相关标准;
(2) 扩展用药的 IND 申请或方案不符合递交要求;
(3) 此前符合扩展用药标准且正在进行中的研究,但FDA评估后当前已不再符合扩展用药的标准。
针对任何设计不充分或质控不足的试验将会被暂停:
(1) 任何发生上述 1/2/3期临床试验列举情形的试验,均会被暂停;
(2) 当有合理的证据表明,一项非充分且控制不当的研究阻碍了另一项设计为充分且控制良好的、针对相同或另一种研究性药物的研究的招募,或干扰了其进行或完成;
(3) 研究药物的数量不足以同时开展非充分且控制不当的研究和充分且控制良好的研究;
(4) 研究药物已通过一项或多项设计充分且控制良好的试验证明其缺乏有效性;
(5) 已存在另一种用于相同适应症且适用于相同患者群体的在研药物或已批准的药物,其潜在获益/风险比更优;
(6) 研究药物已获得针对相同患者群体的相同适应症的上市批准;
(7) 设计进行充分且良好控制的临床试验的IND申请人未尽责积极寻求研究药物的上市批准;
(8) FDA的审评人员认为进行或继续该研究不符合公众利益。
通常情况下,针对上述情形中的(2)(3)(5),FDA意图让临床暂停仅适用于非同时受控的研究的额外入组,而不是消除已经接受研究药物的个体继续获得研究药物的机会。
2、导致临床试验暂停的原因举例
造成临床试验暂停的原因通常来自产品的化学、制造和控制(Chemical, manufacturing, and controls, CMC)、临床前研究或临床内容不充分或不合理。以下是一些可能造成临床试验暂停的例子:CMC:
• 产品的杂质特征表明存在潜在的健康危害,或者杂质特征不足以评估健康危害;
• 产品在整个测试过程中无法保持化学稳定性。
临床前:
• 动物研究数据不足以支持拟定临床试验的预期暴露(剂量、给药途径和持续时间);
• 用以支持产品在人类中使用的关键毒理试验为质量较差的非GLP毒理学试验,难以解释结果,且安全信号尚未得到充分研究。
临床:
• 已观察到的产品毒性在临床方案中未设置充分的毒性监测/管理措施;
• 对于极有可能发生不可预测的急性反应的产品,所有受试者同时给药,而未考虑错开受试者给药时间;
• 临床方案、研究者手册、知情同意书中存在误导性信息(疗效、安全性)。
3、临床试验暂停令的发布与解除
FDA通常会通过远程会议告知IND申请人临床试验暂停的决定及相关问题,并在召开远程会议起30日内向IND申请人发送书面的临床试验暂停通知函(clinical hold letter),详细列明临床研究被暂停的原因。如果IND申请人不认同临床暂停的理由,可以通过监察员提出申诉,或通过A 类会议(Type A meeting)与FDA就临床试验暂停的原因进一步讨论。在申请A类会议时,IND申请人需要递交会议简报文件,FDA将在收到A类会议申请的14天内做出是否同意会议的回应,并在30天内安排会议。IND申请人若想解除临床实验暂停令,应以书面形式提交对所有临床试验暂停缺陷的完整答复(Complete response)。FDA将在收到后30个日历日内审查。如果确定IND申请人的答复已充分解决这些缺陷,FDA将会解除临床试验暂停令。
4、规避临床试验暂停的建议
如前文所述,造成FDA发布临床试验搁置令的原因涉及多种,包括但不限于产品质量、临床前/临床研究设计的科学性、安全性问题等。为了尽可能规避IND临床试验暂停,以下的建议供参考:(1)关注药物开发过程的合规性
严格遵循GMP(药品临床试验管理规范)、严格遵循GMP(药品临床试验管理规范)、GLP(药品非临床研究质量管理规范)和GCP(药品临床试验管理规范),关注监管机构发布的行业指南,以符合监管要求。
(2)明确科学的产品开发计划
在开发新药物时,应该制定的一份详细以患者为中心的产品规划文件,动态调整药物在不同临床阶段的开发计划,并且及时合理规划CMC和临床前的开发。
(3)与监管机构保持密切沟通
与FDA或其他监管机构建立良好的沟通渠道可以及时解决潜在的问题,确保试验/开发计划和实施符合监管要求。同时,也可通过早期沟通(如INTERACT, preIND)渠道,获取FDA的指导,规避风险。
(4)完善的IND申报资料准备
申报资料是递交IND时证明药品安全性及质量可控的重要依据,其内容不仅应符合ICH-M4-CTD指南的撰写规范,还应遵循FDA相关法规及技术指导原则,以提高申报成功率。申报资料的撰写应确保信息真实、准确和一致,并且具有可读性。
(5)选择合适的合作伙伴
如果缺乏IND申报的相关经验,可以考虑与专业的CRO(合同研究机构)合作,利用其丰富的经验和资源来规避临床试验搁置的风险。Michael等人对2014年-2017年被临床搁置的肿瘤药及生物制品进行了原因分析,发现大部分获得暂停的IND是由经验有限的申请人递交(54/75, 72%)。因此,与经验丰富的团队合作,有利于提高IND申请的成功率。
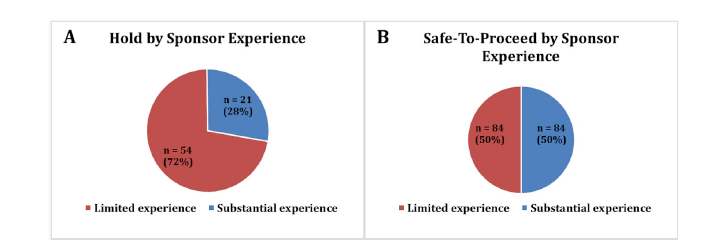
图1:Outcome of IND review by sponsor experience.
(A) INDs on hold; (B) INDs that were STP. More INDs on hold were submitted by sponsors with limited experience
(A) INDs on hold; (B) INDs that were STP. More INDs on hold were submitted by sponsors with limited experience
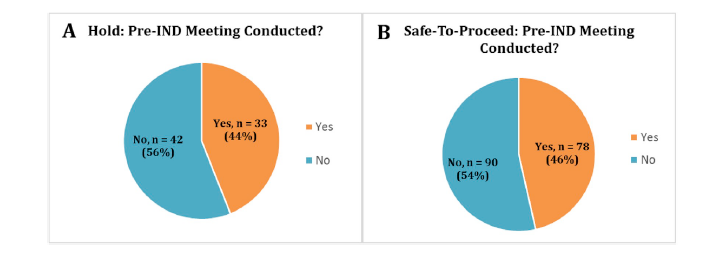
图2:Number of applications with pre-IND meetings.
(A) The number of pre-IND meetings for INDs on hold, (B) The number of pre-IND meetings for INDs that were STP
(A) The number of pre-IND meetings for INDs on hold, (B) The number of pre-IND meetings for INDs that were STP
参考文献
[1]21CFR312.45
[2]21CFR312.42
[3]Carolyn A. Wills, Daniela Drago, and Robert G. Pietrusko. Clinical holds for cell and gene therapy trials: Risks, impact, and lessons learned. Molecular Therapy, Methods & Clinical Development Vol. 31 December 2023. https://doi.org/10.1016/j.omtm.2023.101125
[4]Boudes, P.F. An Analysis of US Food and Drug Administration Clinical Hold Orders for Drugs and Biologics: A Prospective Study Between 2008 and 2014. Pharm Med 29, 203–209 (2015). https://doi.org/10.1007/s40290-015-0105-7
[5]Michael L etc,. An FDA analysis of clinical hold deficiencies affecting investigational new drug applications for oncology products. Regulatory Toxicology and Pharmacology. https://doi.org/10.1016/j.yrtph.2019.104511
